Clasificación de la materia
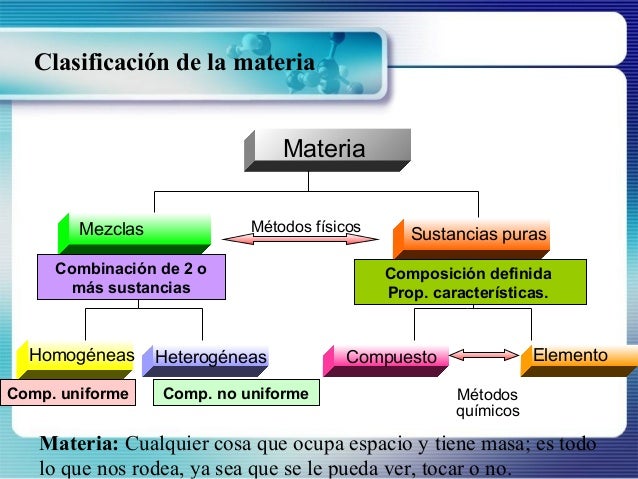
Figura 1.
Antes de entrar en el tema de soluciones es necesario definir algunos términos que aparecen en la figura 1.
La materia es cualquier cosa que ocupa un espacio y que tiene masa. La materia la podemos conseguir en forma de mezcla y de sustancias puras. Las sustancias puras son formas de materias que tienen una composición definida (es decir constante) y propiedades características. Si combinamos dos a más sustancias obtenemos las mezclas, cuya características resaltante es que cada componente conserva sus propiedades
Las mezclas homogéneas son aquellas cuya composición y propiedades son constantes en toda su extensión, por lo que se dice que son uniformes y sus componentes no pueden observarse a simple vista.
Las mezclas heterogéneas son aquellas cuya composición no es constante en toda su extensión y sus componentes pueden ser distinguibles a simple vista.
Los compuestos son sustancias formadas por átomos de dos a más elementos unidos químicamente en proporciones definidas y que pueden ser separados en los elementos constituyentes por métodos químicos. Los elementos son sustancias que no se pueden separar en sustancias más simples y constituyen las unidades fundamentales con las que se construyen los compuestos.
Soluciones o disoluciones
De acuerdo a la figura 1, podemos definir las disoluciones como mezclas homogéneas formadas por dos o más sustancias, el término homogéneo lo confiere a las soluciones la cualidad de que su composición y propiedades sean constantes en toda su extensión, sin ser observables sus componentes, pero conservando cada uno de ellos su identidad química, por lo que es posible separarlos a través de métodos físicos de separación.
Las soluciones más sencillas son aquellas que contienen dos componentes, el soluto y el solvente, a este tipo de soluciones se les conoce como soluciones binarias. El soluto es la sustancia que se encuentra presente en menor cantidad y disperso en el solvente, mientras que el solvente es la sustancia que está en mayor cantidad y es quien dispersa al soluto.
Clasificación de las soluciones:
a-. De acuerdo al estado físico:
En la naturaleza podemos encontrar las soluciones en los tres estados de las materias: sólidos, líquido y gaseoso. El estado físico de la solución va a depender del estado del solvente, tal como se muestra en el siguiente cuadro:
Tabla 1. Estado físico de las soluciones
El solvente de las soluciones pueden ser el agua u otra sustancia como por ejemplo el benceno, tetracloruro de carbono, percloroetileno y acetona. Cuando el disolvente es agua se denominan soluciones acuosas.
b-. De acuerdo a la cantidad de componentes:
Las soluciones pueden tener dos o más componentes, en función a esto se clasifican en:
a-. Soluciones Binarias: Dos componentes.
b-. Soluciones Ternarias: Tres componentes.
c-. Sistemas multicomponentes: Cuatro o más componentes.
c-. De acuerdo al grado de saturación:
a- Soluciones insaturadas: Son aquellas que contienen una cantidad de soluto disuelto menor a la máxima cantidad que se puede disolver en el solvente, a una temperatura determinada.
b- Soluciones saturadas: Son aquellas que contienen disuelto la máxima cantidad de soluto que se puede disolver en el solvente, a una temperatura determinada.
c- Soluciones Sobresaturadas: Son aquellas que contienen una cantidad de soluto mayor a la máxima cantidad que se puede disolver en el solvente, a una temperatura determinada.
d-. De acuerdo a la conducción de electricidad:
a- Soluciones electrolíticas: Son aquellas soluciones que son buenas conductoras de la corriente eléctrica.
b- Soluciones no electrolíticas: son aquellas soluciones que no conducen la corriente eléctrica.
La forma en que se puede establecer cuantitativamente la proporción de mezcla, se denomina concentración de una solución y se puede expresar de variadas maneras, siendo las más usadas:
a-. Soluciones Binarias: Dos componentes.
b-. Soluciones Ternarias: Tres componentes.
c-. Sistemas multicomponentes: Cuatro o más componentes.
c-. De acuerdo al grado de saturación:
a- Soluciones insaturadas: Son aquellas que contienen una cantidad de soluto disuelto menor a la máxima cantidad que se puede disolver en el solvente, a una temperatura determinada.
b- Soluciones saturadas: Son aquellas que contienen disuelto la máxima cantidad de soluto que se puede disolver en el solvente, a una temperatura determinada.
c- Soluciones Sobresaturadas: Son aquellas que contienen una cantidad de soluto mayor a la máxima cantidad que se puede disolver en el solvente, a una temperatura determinada.
d-. De acuerdo a la conducción de electricidad:
a- Soluciones electrolíticas: Son aquellas soluciones que son buenas conductoras de la corriente eléctrica.
b- Soluciones no electrolíticas: son aquellas soluciones que no conducen la corriente eléctrica.
La forma en que se puede establecer cuantitativamente la proporción de mezcla, se denomina concentración de una solución y se puede expresar de variadas maneras, siendo las más usadas:
1.-
Porcentaje de masa de soluto en masa de solución, % m/m.
2.-
Porcentaje de masa de soluto en volumen de solución, % m/v.
3.-
Porcentaje de volumen de soluto en volumen de solución, % v/v.
4.-
Molaridad, M.





Comentarios
Publicar un comentario